Prothesen, Implantate, Nahtmaterial, sie alle sollen möglichst keine negativen Auswirkungen auf umliegendes Gewebe und allgemein auf den menschlichen Körper besitzen. Ein Schlagwort, das immer wieder für medizinische Werkstoffe verwendet wird, ist „Biokompatibilität“. Aber wie wird sie definiert und inwiefern liefert eine USP Class VI Klassifizierung eine Aussage, wie „biokompatibel“ ein Material ist?
Was ist Biokompatibilität?
Seit den 1940er Jahren interessieren sich Wissenschaftler für die Reaktion des Körpers auf implantierte Stoffe. Das erste Mal wurde der Begriff Biokompatibilität jedoch vermutlich erst im Jahr 1970 verwendet.
Biomaterialien sind nichtlebende natürliche oder synthetische Werkstoffe, die im Kontakt mit dem lebenden Körper Einsatz finden und deshalb als oberste Anforderung biokompatibel sein müssen. Da es unterschiedlichste Einsatzgebiete und Expositionszeiten für Biomaterialien in der Medizintechnik gibt, ist Biokompatibilität eine kontextbezogene Eigenschaft und besitzt keine absolute Definition, sondern es existieren sehr viele verschiedene. Über die Zeit wurden die bestehenden Definitionen an neue Erkenntnisse angepasst und erweitert.


Lange Zeit wurden biokompatible Materialien als chemisch und biologisch inert innerhalb des menschlichen Körpers angesehen, was inzwischen revidiert wurde, da immer eine Antwort des Körpers stattfindet. Die IUPAC definiert Materialien als biokompatibel, wenn durch den Kontakt mit dem lebenden System kein nachteiliger Effekt entsteht.[1] Häufig zitiert wird auch die Definition von David F. Williams: „The ability of a material to perform with an appropriate host response in a specific application“, was in etwa bedeutet „Biokompatibilität ist die Fähigkeit eines Materials im Einsatz zu einer angemessenen Wirtsreaktion zu führen.“[2]
Was eine „angemessene Wirtsantwort“ darstellt wird nicht genauer definiert und wurde vermutlich auch absichtlich so offen formuliert.
Biokompatibilität als Materialeigenschaft?
Unter dem Begriff „Biokompatibilität“ wird eine ganze Reihe von Materialmerkmalen verstanden, die je nach Anwendung erfüllt werden müssen, weshalb Biokompatibilität oft als reine Materialeigenschaft angesehen wird. Jedoch sind auch die Beschaffenheit des gefertigten Implantats wie z. B. seine Dichte, seine Oberflächenstruktur und die mechanischen Eigenschaften wichtige Kriterien. Meist werden auch mehrere Materialien verarbeitet, sodass unter Umständen auch Interaktionen zwischen den verschiedenen Werkstoffen entstehen können. Deshalb ist es in der Medizintechnik erforderlich, auch das fertige Produkt zu prüfen und nicht nur die Ausgangsmaterialien.

Heute wird der Ausdruck „biokompatibles Material“ in der medizinischen Forschung kontrovers diskutiert und Williams selbst hat sich 2014 mit seiner Veröffentlichung mit dem Titel „There is no such thing as a biocompatible material“ („Es gibt kein biokompatibles Material“) entsprechend geäußert.[3]
Eine körperfremde Substanz im menschlichen Körper ruft immer eine mehr oder weniger starke Immunantwort hervor, die „Fremdkörperreaktion“ genannt wird. Auch biokompatible Materialien rufen eine solche Reaktion hervor, wenn auch vergleichsweise in geringerem Maße. Heutzutage ist es deshalb ein wichtiges Forschungsthema Fremdkörperreaktionen zu erforschen, um sie minimieren zu können.[4]


Da Biomaterialien also nicht völlig inert sein können und weil Biokompatibilität ein sehr weitgefasster Begriff ist, wurden mittlerweile alternative Einordnungen wie bioinert, biotolerant und bioaktiv zur einfacheren Unterscheidbarkeit eingeführt.
Wie kann Biokompatibilität gemessen werden?
Auch wenn, wie oben erläutert wurde, die Biokompatibilität eines Medizinprodukts von weiteren Faktoren als vom reinen Material abhängt, werden wir im Weiteren der Einfachheit halber, wenn auch nicht ganz korrekt, trotzdem diese Begrifflichkeit verwenden.
Es ist natürlich sinnvoll, zunächst die Ausgangsstoffe eines medizinischen Produkts auf Biokompatibilität zu testen, um sicherzustellen, dass auch das fertige Produkt mit hoher Wahrscheinlichkeit biokompatibel ist. Dabei werden die Ausgangsstoffe in aller Regel von dessen Hersteller geprüft, das fertige Produkt dann vom Hersteller des Medizinproduktes selbst.


Generell werden Tests durchgeführt, die zu einer von zwei Kategorien gehören. Zum einen wird bestimmt, ob und in welchem Umfang (toxische) Bestandteile aus einem Material herausgelöst werden können. Zum anderen werden in vitro (außerhalb des lebenden Organismus) oder in vivo (am lebenden Organismus) Tests durchgeführt, um die Immunreaktion des Körpers auf die zu prüfenden Biomaterialien zu bestimmen.
USP Class VI Zulassung und die Zytotoxizitätsprüfung nach USP Artikel <87>
Eine wichtige Klassifizierung, vor allem für medizinische Kunststoffe, ist die USP Class VI-Einstufung, die in der United States Pharmacopeia (USP), einem jährlich neu aufgelegtem Handbuch für Arzneimittel, beschrieben ist. In Artikel <88> werden Richtlinien und Testprotokolle für medizinische Elastomere und andere Kunststoffe und polymere Werkstoffe erläutert.
USP Class VI ist dabei die strengste von sechs Kategorien und entspricht einer Pharmazulassung für polymere Materialien.
Die Biomaterialien werden in folgenden drei Bereichen in vivo-Tests unterzogen: akute systemische Toxizität, intrakutane Reaktivität und ein Kurzzeitimplantationstest. Die USP Class VI Zulassung wird als Pharmazulassung für medizinische Kunststoffe gehandelt, von vielen Behörden wird sie jedoch nur als eine Mindestanforderung gesehen, um das Material in medizinischen Produkten verwenden zu dürfen. Genauere Informationen zur USP Class VI-Zertifizierung sind in unserem Artikel: USP Class VI Zulassung – Was bedeutet das? zu finden.
Neben Artikel USP <88> beschreibt auch Artikel <87> ein Prüfverfahren, das für die Abschätzung der Biokompatibilität von medizinischen Kunststoffen verwendet wird, und zwar wird die Zytotoxizität eines Materials getestet, also inwiefern die Zellen durch das Material geschädigt werden. Bei diesem in vitro-Testverfahren werden Extrakte des Materials in ein Zellkulturmedium eingebracht und die Wachstumshemmung von Mäusefibroblasten beobachtet. Tatsächlich ist oft der Zytotoxizitätstest kritisch, da in 90% der Fälle das Material den Test nicht besteht. Deshalb macht es oft Sinn, wenn dieser Test erforderlich ist, ihn zuerst durchzuführen.
Vergleich der Prüfungen gemäß USP Richtlinien mit der DIN EN ISO 10993 Norm
Strengere Anforderungen an die Zulassung stellt die DIN ISO 10993 Richtlinie, die zunehmend an Bedeutung gewinnt. In ISO-10993-1 werden die geforderten Tests aufgeführt, während sie in den weiteren ISO 10993 Normen erläutert werden.
Einen groben Überblick über beide Einstufungen zeigt die folgende Darstellung:
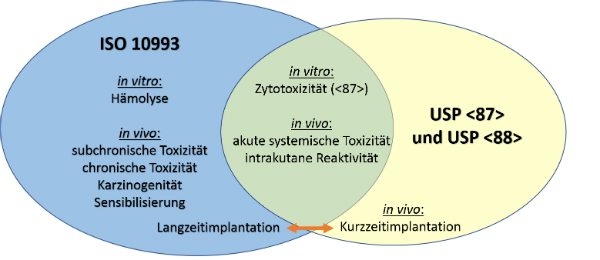
Auch wenn – wie in der Graphik dargestellt – sich einige Tests überschneiden, ist es meist der Fall, dass die Mindestanforderungen für einen Test unterschiedlich sind. Wenn sowohl USP Class VI- und ISO 10993-Zertifizierungen benötigt werden, können die strengeren Anforderungen erfüllt werden und so entfallen einige Tests gegenüber zwei eigenständigen Zertifizierungen.
Eine USP Class VI Einstufung ist zeit- und kostengünstiger als eine Prüfung auf ISO 10993 Konformität und stellt trotzdem eine erste, gute Entscheidungshilfe für Hersteller von Medizinprodukten dar, welche Kunststoffe in Frage kommen.
Welcher Biokompatibilitätstest erforderlich ist, hängt stark von der jeweiligen Anwendung und damit auch von der Anwendungsdauer des fertigen Produkts ab. ISO 10993 wurde für medizinische Produkte entwickelt, die permanent oder sehr lange im menschlichen Körper bleiben, deshalb reicht für kürzere Anwendungen oft eine USP Class VI oder auch sogar eine niedrigere USP Class Zertifizierung.


In Deutschland ist außerdem für die Zulassung von Medizinprodukten ein Konformitätsbewertungsverfahren erforderlich, in dessen Rahmen für solche Produkte der Medizintechnik in der Regel auch eine klinische Prüfung durchgeführt wird.
Gleichzeitig sollte man auch im Hinterkopf behalten, dass, wie zu Beginn des Artikels erläutert, neben Materialeigenschaften auch weitere Faktoren die Biokompatibilität beeinflussen.
Quellen: [1] Terminology for Biorelated Polymers and Applications, IUPAC Recommendations 20XX [2] The Williams dictionary of Biomaterials, D.F. Williams, 1999, ISBN 0-85323-921-5 [3] D. F. Williams, Biomaterials 2014, 35, 10009-10014. [4] H. Hartmann, BIOmaterialien 2010, 11, 15-23.
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
