« Neue Materialien aus Kohlenstoff »
Seit mehr als 40 Jahren beschäftigt sich die Forschung an Hochschulen und in der Industrie mit Materialien aus Kohlenstoffatomen, für die sich ganz neue Anwendungen ergeben. Viele Millionen Kohlenstoffverbindungen sind heute bekannt – manche kommen in der Natur vor, wieder andere werden künstlich erzeugt. Zu den verhältnismäßig jungen Entdeckungen gehören die Fullerene, die Nanotubes und das Graphen. Sie sind, wie Diamant und Graphit, Modifikationen des Kohlenstoffes, also nur aus dem Element Kohlenstoff bestehende Moleküle unterschiedlicher Struktur. Jedes für sich hat aufgrund seiner molekularen Struktur ganz spezifische Eigenschaften, die ebenso vielfältig wie ihre jeweiligen Anwendungen sind. Der folgende Artikel stellt diese neuen Materialien vor und gibt einen kleinen Überblick über ihre jeweiligen Einsatzmöglichkeiten.
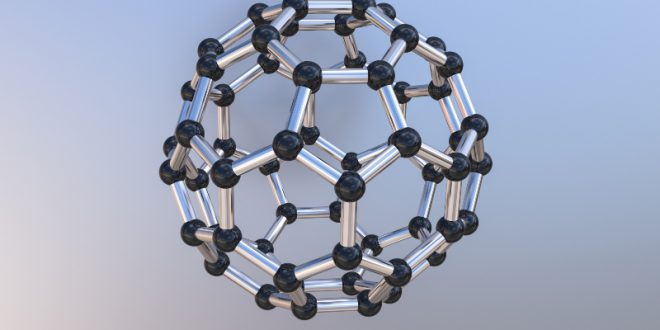
Fulleren – das „Fußball“-Molekül
Mitte der 80er-Jahre des 20. Jahrhunderts gelang es durch Verdampfen von Graphit in einem Laserstrahl eine weitere Modifikation des Kohlenstoffs künstlich herzustellen. Die dabei entstandenen, käfigartigen Moleküle wurden nach dem amerikanischen Architekten Richard Buckminster Fuller (1895 – 1983), der durch den Bau von Kuppeln an Berühmtheit gewann, als Fullerene benannt. Die aus Fullerenen aufgebauten Stoffe heißen Fullerite. Sie sind bei Raumtemperatur kristallin, weich und sehr elastisch.

Das wohl bekannteste Fulleren ist das Buckminsterfulleren. Im Jahr 1990 gelang es diese besondere Form der Fullerene im größeren Maßstab durch Verdampfen von Graphit im Lichtbogen aber auch mit Hilfe eines elektrischen Stroms in einer Unterdruckatmosphäre aus Argon und Helium zu synthetisieren. Dieser Meilenstein ist dem US-amerikanischen Physiker Donald R. Huffman (*1935) in Zusammenarbeit mit dem deutschen Physiker Wolfgang Krätschmer (*1942) zuzuschreiben.
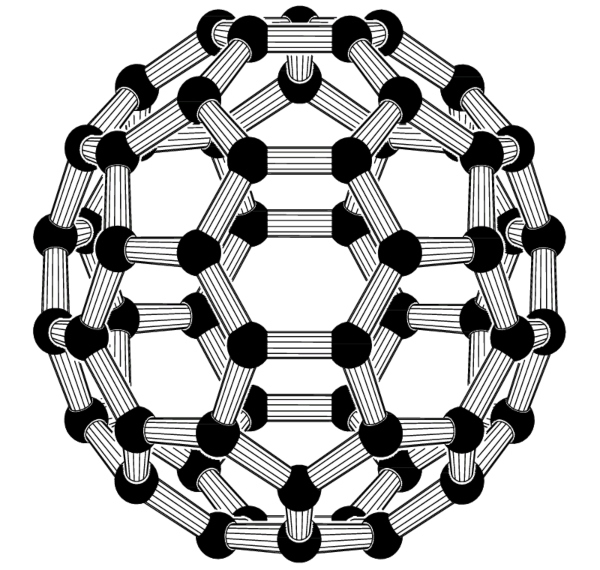
Das Buckminsterfulleren besteht aus genau 60 Kohlenstoffatomen und ist ein kugelförmiges Molekül mit einem Durchmesser von 0,7 Nanometern. Ein Nanometer entspricht dabei einem Milliardstel Meter, oder anschaulicher: Das auch kurz mit C60 bezeichnete Buckminsterfulleren-Molekül ist damit circa 300 mal kleiner als ein Fußball, ein Größenverhältnis wie zwischen einem Tischtennisball und der Erde. Das C60-Molekül ist aus 20 Sechsringen und 12 Fünfringen aufgebaut, weshalb es oft auch „Fußball“-Molekül oder „Buckyball“ genannt wird. Wie im Graphitgitter hat auch hier jedes Atom drei Bindungspartner. Das vierte Valenzelektron ist auf der Moleküloberfläche frei beweglich. Neben weiteren bekannten Fullerenen wie dem C80 oder C94Molekül hat das nächstgrößere C70-Molekül die Form eines Rugbyballs.
Das Buckminsterfulleren ist oft in carbonfaserverstärkten Kunststoffen (CFK) enthalten, aus denen besonders leichte und trotzdem stabile Sportartikel, wie Golf-, Tennis- oder Badmintonschläger, gebaut werden. Sie sind darüber hinaus Radikalfänger und werden deshalb diversen Kosmetika, wie Anti-Aging–Cremes, zugesetzt. Radikale sind überaus reaktionsfreudige Teilchen, genauer Atome oder Moleküle mit mindestens einem ungepaarten Valenzelektron, und für den Alterungsprozess der Haut mitverantwortlich. Fullerene sind wegen ihrer hohen Elektronenaffinität in der Lage, diese in der Umwelt befindlichen Radikale zu binden und für den Körper unschädlich zu machen. Da Buckminsterfullerene aber biologisch nicht abbaubar sind und wenig über die Langzeitwirkung bekannt ist, verzichten einige Kosmetikfirmen auf den Zusatz dieser speziellen Modifikation des Kohlenstoffs.
Nanotubes – Röhren aus Kohlenstoff
Im Laufe der 90er-Jahre des 20. Jahrhunderts wurden von dem japanischen Physiker Sumio Idijama (*1939) bei der Darstellung von Fullerenen Ablagerungen in Form winziger, zylinderförmiger Röhrchen entdeckt. Untersuchungen der Rückstände ergaben, dass sich diese ebenfalls aus Kohlenstoffatomen zusammensetzten.


Mithilfe eines Elektronenmikroskopes konnte die Struktur dieser Kohlenstoff-Nanotubes (engl. carbon nanotubes, CNT) ausgemacht werden, welche sich nur geringfügig von denen der Fullerenen und des Graphits unterscheidet. Bei den Kohlenstoff-Nanoröhren handelt es sich, wie der Name schon sagt, um röhrenförmige Moleküle mit einem Durchmesser zwischen etwa 1 bis 50 Nanometern und einer Länge von wenigen Millimetern bis hin zu 20 Zentimetern. Die Wände der Nanotubes bestehen aus wabenartig zusammengesetzten Kohlenstoff-Sechsringen.

Die je nach Durchmesser und Länge unterschiedliche elektrische Leitfähigkeit der Nanotubes ermöglicht die Herstellung monomolekularer Transistoren als Verbindung innerhalb mikrostruktureller Verbände zum Einsatz in der Medizin und Elektronik. Ein weiteres Einsatzgebiet betrifft die Biochemie. Die Möglichkeit der Öffnung und Schließung der Nanotubes zu kleinen Kapseln erlaubt den Einschluss von Kristallen oder Enzymen zur Untersuchung und damit Steuerung enzymatischer Prozesse.


Ferner gibt es auch doppel- und mehrwandige Nanotubes mit Durchmessern über 100 Nanometern. In seiner Zugfestigkeit übertrifft dieses Material den Stahl, weist zugleich aber wegen der hohlen Struktur eine deutlich niedrigere Dichte auf. Diese besonderen Eigenschaften könnten, so das Projekt DaNa4.0, ein Projekt zur Darstellung wissenschaftlicher Inhalte zum Thema Nanomaterialien, positiv zur Energiewende in Deutschland beitragen: Der Einsatz zur Verbesserung von Batterieeigenschaften, Aufbau stabilerer Rotorblätter von Windkrafträdern zur Stromerzeugung und Anwendungen in der Solar- und Brennstoffzellentechnologie mit Hilfe der Speicherung von Wasserstoff-Molekülen innerhalb der Nanotubes könnten einen positiven Beitrag zur effizienteren Stromerzeugung leisten. Auch eine Modifikation der Oberfläche der Nanotubes mit Carbonsäure- oder Amin-Strukturen ist zur Veränderung der Eigenschaften möglich.
Graphen – der Baustein für weitere Modifikationen des Kohlenstoffs
In der zweidimensionalen, wabenförmigen Struktur ist jedes Kohlenstoff-Atom im Graphen mit drei Weiteren kovalent verbunden. Aufgrund der Struktur des Graphens entspricht die Dicke einer Schicht genau dem Durchmesser eines Kohlenstoff-Atoms, nämlich 0,08 Nanometern. So ist eine Graphen-Schicht etwa eine Million mal dünner als ein handelsübliches Blatt Papier.
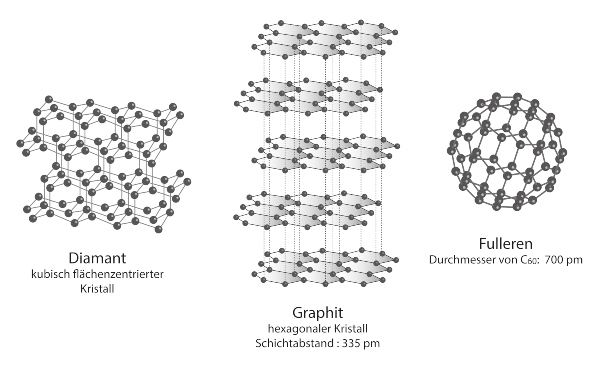
Werden die Strukturen der anderen Modifikationen von Kohlenstoff mit Graphen verglichen, fallen Gemeinsamkeiten auf: Ein Nanotube aus Kohlenstoff kann wie ein aufgerolltes Stück Graphen verstanden werden; ein einzelner Graphit-Kristall besteht im Grund aus mehreren, gestapelten Schichten von Graphen.
Da im Graphen jedes Kohlenstoff-Atom nur drei Bindungspartner hat, sind auch hier, wie im Graphit, frei bewegliche Valenzelektronen vorhanden. Diese können sowohl Ladung als auch Energie transportieren – und das sogar anderthalb mal besser als Kupfer. Darauf beruht die elektrische Leitfähigkeit des Graphens und zeichnet es zudem als guten Wärmeleiter aus. Aufgrund dieser herausragenden Eigenschaften ist die Forschung an besonderen Anwendungsgebieten des Graphens interessiert. Neben der Herstellung elektrisch leitfähiger Kunststoffe und Kondensatoren mit sehr hoher Kapazität, ist Graphen ebenfalls geeignet als Ersatz des Siliciums in Mikrochips und Solarzellen sowie als Kühlkörper für andere elektronische Geräte. Auch im Bereich der Energieerzeugung und -speicherung sei Graphen ein Hoffnungsträger, so Björn Trauzettel (*1973), theoretischer Physiker und Lehrstuhlinhaber an der Universität Würzburg. Anwendungen seien auch im Bereich der flexiblen Elektrotechnik vorstellbar, beispielsweise als aufrollbare Displays.


Die verschiedenen Modifikationen des Kohlenstoff und vor allem die neuen, künstlich hergestellten Materialien aus diesem vielseitigen Element, wie die Fullerene, die Nanotubes oder das Graphen, revolutionieren Teilgebiete der Wissenschaft, der Technik und der Industrie und eröffnen weitreichende, neue Einsatzmöglichkeiten.
Bildquellen: Beitragsbild | © hawanafsu – stock.adobe.com Biosphère in Montreal | © Thomas Ledl – de.wikipedia.org Struktur des C60-Fullerens | © Rob Hooft – commons.wikimedia.org Darstellung eines Kohlenstoff-Nanoroehrchens | © User:Gmdm / EL0807 – commons.wikimedia.org Strukturvergleich verschiedener Kohlenstoff-Modifikationen | © natros – stock.adobe.com
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin