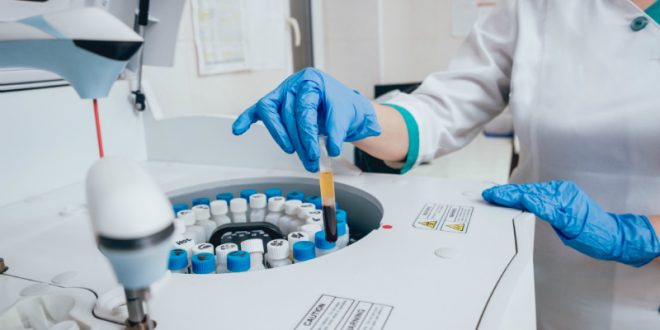
Die Biochemie befasst sich mit der Aufklärung der Molekülstrukturen von Naturstoffen und ihren Wirkmechanismen in lebenden Organismen. Eine der Grundoperationen dafür ist die Separation der interessierenden Stoffe aus biologischem Material, um sie in vitro untersuchen zu können. Da bioaktive Naturstoffe außerhalb der Organismen jedoch meist sehr schnell denaturieren und dabei ihre Bioaktivität verlieren, sind die gängigen Abtrenn- und Reinigungsverfahren der klassischen, präparativen Chemie hierfür ungeeignet. Infrage kommen statt den dort gängigen Separationstechniken vor allem stoffschonende Filtrationstechniken und chromatografische Verfahren.
Generelle Aspekte der Separationstechnik
In der Biochemie wird mit empfindlichem Material gearbeitet, mit Bestandteilen aus Bakterien, Pflanzenzellen oder tierischem Gewebe, mit Proteinen, Nucleotiden oder auch mit Nukleinsäuren, wie DNA und RNA. Zu den typischen Aufgaben im biochemischen Labor gehört die möglichst schonende Isolierung des interessierenden Stoffs aus einem Gemisch vieler, meist sehr ähnlicher Stoffe, beispielsweise eines speziellen Proteins aus einem Pflanzenaufschluss.
Bereits das Aufschließen des biologischen Materials kann zu Veränderungen der Struktur und Bioaktivität der interessierenden Stoffe führen, viel mehr jedoch noch im nächsten Schritt, der Isolierung.
Deshalb können klassische chemische Trennverfahren und Separationstechniken hierfür nicht in Betracht kommen. Biochemische Separationsverfahren beruhen vielmehr auf der Trennung nach der Molekülgröße, der Dichte oder nach spezifischen Bindungseigenschaften. So können durch Dichtegradient-Zentrifugation in einem Saccharosegradienten unterschiedliche Zellorganellen sehr schonend getrennt werden. Die Affinität zu bestimmten Liganden spielt bei der chromatographischen Trennung eine wesentliche Rolle. Schließlich sind die Dialyse und die Filtration zwei schonende Separationsverfahren, die Partikel anhand ihrer Molekülgröße voneinander trennen.

Bei allen Arbeitsschriften ist ein enges Temperaturfenster einzuhalten, das hingegen bei chemischen Trennverfahren kaum berücksichtigt werden muss. Welches der verschiedenen Separationsverfahren man einsetzen kann und worauf noch zu achten ist, soll im Folgenden an einem typischen Beispiel, der Isolierung eines Proteins aus einer Hefe oder Bakterienkultur, erläutert werden. Dabei spielen vor allem Membran- und Filtrationstechniken, neben der Chromatographie als Trennverfahren bzw. als wichtige Separationstechnik im biochemischen Labor, eine bedeutende Rolle.
Ein typischer Workflow – von der Bakterienkultur zum reinen Protein
Sterile Bedingungen sind das A und O
Bereits im ersten Schritt, der Anzucht und Kultur von Hefen oder Bakterien zur Produktion des gewünschten Proteins in größeren Mengen, kommt die Sterilfiltration zum Einsatz. Während die Nährmedien zur Anzucht der Mikroorganismen in aller Regel autoklaviert werden können und damit steril sind, werden Zusätze, wie Spurenelementlösungen, meist zeitsparend steril filtriert. Das heißt, die Lösung passiert einen sterilen Membranfilter mit einer Porengröße von 0,2 µm, der sich in einem Gehäuse befindet. Diese Porengröße können störende, ubiquitäre Mikroorganismen wie Bakterien nicht passieren. Sie bleiben also auf der Filteroberfläche zurück.
Meist sind die Volumina solcher Lösungen so gering, dass im Labor hierfür spezielle Spritzenvorsatzfilter eingesetzt werden.
Analog muss auch die sterile Begasung der Kulturen mit dem entsprechenden Luftgemisch sichergestellt sein, um Kontaminationen sicher auszuschließen. Die sterile Begasung kann beispielsweise über Sinterfilter, wie Sinterplatte oder Sinterstab, erfolgen. Alternativ kann ein Einmal-Filtervorsatz, der einen hydrophoben Membranfilter aus PTFE (Polytetrafluorethylen) enthält, vorgeschaltet werden.


Zellernte, Zellaufschluss und Trennung
Für die Zellernte muss das Nährmedium von den gezüchteten Hefen oder Bakterien abgetrennt werden. Dieser Schritt erfolgt durch Trennfiltration. Möglich ist beispielsweise ein erster Reinigungsschritt über eine Filterkerze mit Nylonmembran, die die größten Partikel abhält und als grobes Sieb fungiert. Danach erfolgt der Zellaufschluss. Mit dem Aufschluss der Zellen, der beispielsweise über Ultraschall, enzymatisch oder mechanisch erfolgen kann, beginnt nun der Hauptteil der Arbeit, die Stofftrennung. Die Chromatographie ist dabei die bevorzugte Separationstechnik, die ein biochemisches Labor als wichtigstes Trennverfahren anwendet.
Sie nutzt die unterschiedlichen Bindungseigenschaften der freigesetzten Proteine zu bestimmten Liganden, ihr unterschiedliches Sorptionsverhalten oder die unterschiedlichen Molekülgrößen.
Zwischen den einzelnen Trennschritten muss die Probe bzw. das Material jeweils optimal auf den nächsten Schritt vorbereitet werden, denn nicht für jede Separationstechnik bzw. Separationsmethode gelten die gleichen Voraussetzungen. So kann für die Vorbereitung auf den nächsten Schritt eine schonende Entsalzung notwendig sein oder ein Pufferaustausch, wenn beispielsweise auf eine Ionenchromatographie die Gelfiltration als nächster Schritt folgt. In solchen Fällen ist die Dialyse ein schonender Zwischenschritt, um unerwünschte Salze aus dem Probenpuffer zu entfernen.


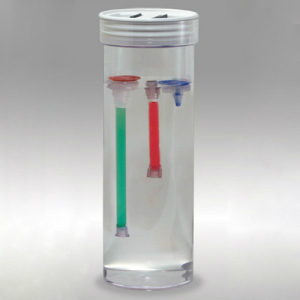
Die Dialyse erfolgt mittels semipermeabler Membranen mit unterschiedlichen, dem jeweiligen Trennproblem angepassten Porenweiten, die für Proteine bestimmter Molekülgrößen undurchlässig sind, während Ionen jedoch hindurchwandern können. Die Ausschlussgröße, der sogenannte Molecular weight cut off (MWCO), gibt das Molekulargewicht der Proteine an, die zu 90 % von der Membran ausgeschlossen werden. In der Praxis werden für die Dialyse gern Dialyseschläuche eingesetzt, die apparativ anspruchslos und daher einfach zu handhaben sind.
Sie sind in vielen Abmessungen und Porenweiten verfügbar, außerdem eignen sie sich für die Bearbeitung von Mengen zwischen wenigen Millilitern bis zu mehreren hundert Millilitern.
Das zu dialysierende Material wird mittels Trichter, zweckmäßig ist die Verwendung von speziellen Dialysierschlauch-Trichtern aus Polypropylen (PP), in den an einem Ende mittels Schlauchklemme verschlossenen Dialyseschlauch gefüllt, der dann am anderen Ende auf gleiche Weise verschlossen wird. Der gefüllte Dialyseschlauch wird nun in einen größeren Behälter gegeben, der entweder mit einer Pufferlösung für den Pufferaustausch oder mit Wasser für die Entsalzung gefüllt ist. Die Effektivität der Dialyse wird durch Rühren und mehrfachen Wechsel des vorgelegten Austauschmediums, Pufferlösung oder Wasser, unterstützt. Für kleinere Volumina bzw. Mengen im µl-Bereich wird die Mikrodialyse angewandt, bei der der Dialyseschlauch durch dünne Hohlfasern ersetzt wird.

HPLC: Die Hochleistungsflüssigkeitschromatographie als wichtige Separationstechnik im biochemischen Labor
Eine weit verbreitete Separationstechnik ist die HPLC (high performance liquid chromatography), eine inzwischen hochtechnisierte chromatographische Methode, die sich sowohl für die Stoffanalyse als auch zur präparativen Stofftrennung eignet. Sie ist nicht nur im biochemischen Labor anzutreffen, sondern auch in der Chemie weitverbreitet. In der Biochemie wird sie beispielsweise eingesetzt, um Metaboliten oder Umsetzungsprodukte von enzymatischen Reaktionen näher zu charakterisieren. Die HPLC ist eine sehr empfindliche Analyse- und Separationstechnik, bei der für die Auftrennung speziell präparierte Säulen eingesetzt werden. Da sowohl die Proben als auch die verwendeten Laufmittel unbedingt partikelfrei sein müssen, um das Verstopfen der Kapillarleitungen wie auch die Inaktivierung des empfindlichen Säurenmaterials zu vermeiden, ist die Vorreinigung beider Komponenten durch Filtration für diese Separationstechnik erforderlich.

Dafür werden vorteilhaft Membranfilter eingesetzt, die im Gegensatz zu üblichen Papierfiltern den zusätzlichen Partikeleintrag sicher ausschließen. Für Fließmittel ist die kontinuierliche Vorreinigung durch den Einbau von Inline-Filtern (flow-through-Filter) in den Fließmittel-Zustrom oder die Verwendung von Filterkerzen (Tauchkerzen) zweckmäßig. Für kleinere Volumina, etwa zur Klarfiltration, aber auch zur Sterilfiltration von Proben, sind Spritzenfilter dank ihrer einfachen Handhabung von hohem Nutzen. Einmal-Filtervorsätze für Einwegspritzen mit Membranen sind beispielsweise in den Porengrößen von 0,45 µm oder 0,2 µm erhältlich.


Methodische Unterschiede zwischen biochemischen und chemischen Labor
Die im biochemischen Labor angewandten Trennmethoden und Separationstechniken unterscheiden sich in vielen Details von denen, die im chemischen Labor typischerweise zur Anwendung kommen. Wegen der Sensibilität der Stoffe, die den Biochemiker interessieren, müssen sehr viel schonendere Trennverfahren als in der analytischen oder präparativen Chemie eingesetzt werden. Dabei kommt den stoffschonenden Filtrationstechniken neben den chromatographischen Trennverfahren eine sehr bedeutende Rolle zu: als Separationstechnik bzw. Methode von hochmolekularen, bioaktiven Stoffen, wie Proteinen aus Hefe- oder Bakterienkulturen.
Hierfür bietet sich die Dialyse in Verbindung mit Membranfiltern als einfache Separationstechnik zur Entsalzung und Entfernung von niedermolekularen Stoffen an, aber auch zur Sterilfiltration von Lösungen und Gasen, die für Arbeiten im chemischen Labor praktisch keine Rolle spielt.
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin