Kunststoffe, die in der Medizintechnik und Pharmazie Anwendung finden, werden in der United States Pharmacopeia (USP), dem US-amerikanischen Arzneibuch, in sechs Biokompatibilitäts-Klassen unterteilt. Um Elastomere und andere polymere Werkstoffe einer der Klassen zuzuordnen, werden sie verschiedenen Tests unterzogen, mit deren Hilfe die biologische Reaktivität in vivo bestimmt wird, also im lebenden Organismus.
Dabei stellt die USP Class VI die strengste Klasse dar und wird mit einer Pharmazulassung für polymere Materialien gleichgesetzt.
Kunststoffe haben traditionelle Materialien wie Metall, Holz und Glas in vielen Bereichen unseres Lebens ersetzt und sind daher kaum noch wegzudenken. Deshalb ist es nicht verwunderlich, dass sie auch in der Medizintechnik Einzug gehalten haben.
Kunststoffe werden in den unterschiedlichsten medizinischen Bereichen, sowohl im menschlichen Körper als auch außerhalb eingesetzt. Prothesen, Implantate, Nahtmaterial, Schläuche oder Einwegspritzen sind nur einige wenige Beispiele, die spezifische Materialanforderungen erfüllen müssen. Um eine bestmögliche Verträglichkeit und damit Sicherheit für die Patienten zu gewährleisten, ist es wichtig eine einheitliche Klassifizierung zu haben. Eine der häufigsten verwendeten Einstufungen ist die USP-Klassifizierung, die in diesem Artikel erklärt werden soll.
Wer steckt hinter der USP-Klassifizierung?
USP ist, wie schon erwähnt, die Abkürzung für das offizielle US-amerikanische Arzneibuch United States Pharmacopeia, das die Qualitätsstandards für Arzneimittel, aber auch für Nahrungsergänzungsmittel und Lebensmittelinhaltsstoffe festlegt. Es wird zusammen mit dem National Formulary (NF, dt.: nationale Formelsammlung) jährlich neu veröffentlicht. Herausgeber des Werkes ist die gemeinnützige, nichtstaatliche Organisation mit dem Namen United States Pharmacopeial Convention (i.d.R. ebenfalls USP abgekürzt), mit Sitz in Rockville, Maryland, USA.


Das oberste Ziel der USP ist es, die Gesundheit der Menschen zu erhalten und zu verbessern. Anhand von verbindlichen Richtlinien für die Herstellung von Arzneimitteln und medizinischen Produkten soll die Qualität der untersuchten Substanzen garantiert werden. Dies erhöht die Sicherheit von Patienten und Verbrauchern. Bewertet werden die korrekte Identität des Arzneistoffes, Wirkstoffstärke, Qualität, Reinheit und Zusammensetzung. An den aufgestellten Standards orientieren sich sowohl die Hersteller, als auch die Aufsichtsbehörden. Verschreibungspflichtige sowie nicht-verschreibungspflichtige Medikamente müssen gemäß Bundesgesetz der USA den USP-NF Normen genügen.

Für die Durchsetzung der Richtlinien in den USA ist die Food and Drug Administration (FDA, dt.: Behörde für Lebens- und Arzneimittel) verantwortlich. Erstmals wurden 1990 in Artikel <88> des USP Arzneibuches auch Testprotokolle und Richtlinien für Verpackungen von Medikamenten festgelegt, die dann wegen ähnlicher Anforderungen auch auf Kunststoffe übertragen worden sind, die in der Medizin und Medizintechnik Anwendung finden.
Die wichtigste Grundvoraussetzung für die Verwendung im lebenden Körper bzw. am Menschen ist die Biokompatibilität des eingesetzten Werkstoffes.
Biokompatibilität – Was ist das?
Im Idealfall entsteht durch den Kontakt mit dem lebenden System, mit dem z.B. ein Implantat in Kontakt ist, überhaupt kein nachteiliger Effekt. Dann wird laut IUPAC (International Union of Pure and Applied Chemistry) von Biokompatibilität gesprochen. Nachteilige Effekt können z.B. die Freisetzung von toxischen Substanzen sein oder dass das Gewebe das Polymer nicht annimmt. Deshalb stellt die USP-Klassifizierung ein Maß für die Biokompatibilität eines polymeren Werkstoffs dar.
Wie funktioniert eine USP Class-Einstufung?
Je nach Anwendung werden Anforderungen an medizinisch eingesetzte Materialien gestellt. So reicht beispielsweise für ein Produkt mit Hautkontakt eine USP Class I Einstufung, für eine Anwendung als Implantat oder in Kontakt mit dem Blutkreislauf wird USP Class VI gefordert. Des Weiteren ist auch die Kontaktdauer ein wichtiges Kriterium, nach dem entschieden wird welche Richtlinie nötig ist. Beispielsweise ist bei Kontakt mit Schleimhautoberflächen Class I bei unter 24 Stunden, bei 1 bis 30 Tagen Class III und bei einer Anwendungsdauer von über 30 Tagen Class V vorgeschrieben.
Um eine USP Class VI Einstufung zu erhalten, werden die folgenden Tests des Materials selbst, sowie von verschiedenen Extrakten dieses Materials in externen Prüflaboratorien durchgeführt. Grob lassen sich die folgenden drei Testfelder unterscheiden:
- akute systemische Toxizität: Es erfolgt die Bestimmung der akuten Reizwirkung bei Hautkontakt, Einatmen und Verschlucken.
- intrakutane Reaktivität: Das Testmaterial wird in direkten Kontakt mit dem Gewebe gebracht, für das es im normalen Gebrauch vorgesehen ist.
- Implantationstest: Es wird die Reaktion nach Implantation in das Gewebe eines lebenden Organismus untersucht. Die Zeitdauer beträgt in der Regel fünf Tage.
Diese Tests werden bei festgesetzten Expositionszeiten und Temperaturen durchgeführt, um eine Vergleichbarkeit der Ergebnisse zu gewährleisten. Obwohl die Biokompatibilitätsprüfung am fertigen Medizinprodukt stattfinden muss, ist es für den Hersteller wichtig, dass auch alle verwendeten Ausgangsmaterialen geprüft sind und den Anforderungen des Endproduktes entsprechen.
In sehr vielen Ländern wird die USP Class VI Zulassung für pharmazeutische und medizinische Produkte angewendet und akzeptiert.
Biokompatible Kunststoffe mit USP Class VI Zertifizierung
In der Medizintechnik wird eine Vielzahl von Elastomeren und Thermoplasten verwendet. Sie finden z.B. Anwendung als Fertigungs- oder Beschichtungsmaterial von Dichtungen, O-Ringen und Schläuchen für medizinische Geräte.


Standardmäßig werden biokompatible Kunststoffe wie Polyethylen (PE), Polystyrol (PS), Polyvinylchlorid (PVC), Polycarbonat (PC), Polypropylen (PP) oder Polymethylmethacrylat (PMMA) verwendet.
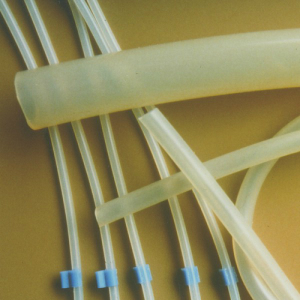

Medizinschläuche sind häufig aus Elastomeren wie Silikon oder TYGON® gefertigt. Auch vollfluorierte Polymere kommen oft zum Einsatz, da sie sowohl biokompatibel sind, als auch chemisch praktisch inert. Außerdem verfügen sie über einen geringen Reibungskoeffizienten, lassen sich gut sterilisieren und haben vorteilhafte dielektrische Eigenschaften.
Weitere Materialien, die in der Medizintechnik einen festen Platz haben sind Polyvinylidenfluorid (PVDF) und Polytetrafluorethylen (PTFE). Sie werden häufig als Materialien für mikroporöse Filtermembranen (0.01 bis 10 μm) zur Sterilfiltration und zur Entfernung von Feinpartikeln eingesetzt.
Neben diesen beiden Kunststoffen kommen auch viele weitere Fluorpolymere wie z.B. Perfluoralkoxy-Polymere (PFA), Fluorethylenpropylen (FEP) und Ethylen-Tetrafluorethylen-Copolymer (ETFE) zum Einsatz.
DIN- ISO-10993 Einstufung und FDA-Konformität
Neben der USP Class VI-Zulassung, die tatsächlich oft lediglich als Mindestanforderung für Biokompatibilität gesehen wird, gewinnt der DIN-ISO-10993-Standard zunehmend an Bedeutung. Dieses Testverfahren ist deutlich zeitaufwändiger und teurer. Auch wenn der ISO-10993-Standard der strengere Standard ist, ist es dennoch empfehlenswert abzuwägen, ob für die angestrebte Verwendung des biokompatiblen Materials bzw. des fertigen Produktes eine solche Zertifizierung nötig ist. Denn für die Mehrheit der Anwendungen genügt eine USP Class VI-Einstufung oder sogar eine niedrigere USP Class-Zertifizierung.
 Oft liest man auch von FDA-zugelassenen Materialien. FDA-Konformität ist vor allem wichtig für die Anwendung im Lebensmittelbereich.
Oft liest man auch von FDA-zugelassenen Materialien. FDA-Konformität ist vor allem wichtig für die Anwendung im Lebensmittelbereich.
Im Paragrafen CFR 21.177.2600 der FDA-Richtlinien werden beispielsweise „Gummiartikel, die für eine wiederholte Anwendung vorgesehen sind“ behandelt.
Es führt zugelassene Elastomere und Substanzen auf, die zu deren Herstellung verwendet werden. Meist wird die FDA-Konformität parallel zur USP Class VI-Zertifizierung aufgeführt.
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin