« Probenvorbereitung im biochemischen Labor »
Die Zentrifuge ist im biochemischen Labor unverzichtbar – denn egal, ob man mit Zellen, Proteinen oder DNA arbeitet – irgendwann kommt der Moment, an dem unerwünschte Bestandteile abgetrennt werden sollen. Neben anderen Techniken, wie der Filtration oder Chromatographie, ist die Zentrifugation eine etablierte und einfach anzuwendende Technik.
Die Grundlagen der Zentrifugation
Bei der Zentrifugation werden die in einem Gemisch mit einem flüssigen Medium vorhandenen festen Partikel aufgrund ihrer unterschiedlichen Sedimentationsgeschwindigkeiten in einem Zentrifugalkraftfeld aufgetrennt. Die Sedimentation hängt dabei von Größe, Form und Dichte der Bestandteile ab. Größere Partikel sedimentieren schneller als kleinere und Partikel mit höherer Dichte sedimentieren schneller als solche mit niedriger Dichte. Außerdem haben die Dichte und die Viskosität des Mediums Einfluss auf die Sedimentationsgeschwindigkeit. In Medien mit hoher Viskosität sedimentieren Teilchen langsamer als in Medien mit niedrigerer Viskosität. Damit kann ein Gemisch aus unterschiedlichen Partikeln mit verschiedenen Größen und Dichten durch Zentrifugieren aufgetrennt werden.

Der schwedische Chemiker und Chemie-Nobelpreisträger des Jahres 1926, The (Theodor) Svedberg (1884 – 1971), war der erste, der diese Zusammenhänge mathematisch fasste und mit seiner als Svedberg-Gleichung bekannten Formel die Sedimentationsgeschwindigkeit von Teilchen berechnen konnte.
Eine für die Biochemie wichtige Größe ist der Sedimentationskoeffizient, der sich aus dem Verhältnis von Sedimentationsgeschwindigkeit und Zentrifugalbeschleunigung ergibt. Dieser Quotient spiegelt eine charakteristische Moleküleigenschaft wider, die experimentell bestimmt werden kann. Sie wird in Svedberg-Einheiten (S) angegeben, für die gilt: 1 S = 1013 Sekunden. Für viele biochemische Partikel sind die S-Werte bekannt, manche sind sogar zum Teil ihrer wissenschaftlichen Bezeichnung geworden, wie beispielsweise für das prokaryotische Ribosom 30S-RNA.
Aufbau und Ausstattung einer typischen Zentrifuge aus dem Labor
Eine Zentrifuge besteht aus dem Rotor, der mit einem Motor zu den gewünschten Umdrehungen angetrieben wird. Er wird mit Zentrifugengefäßen, entweder Zentrifugenröhrchen oder, für größere Probemengen, mit Zentrifugenbechern aus speziellen, dickwandigen Gläsern oder Kunststoffen, wie PTFE, PP oder HDPE, bestückt, die das Probengut aufnehmen. Sie verfügen über konische oder gerundete Böden.
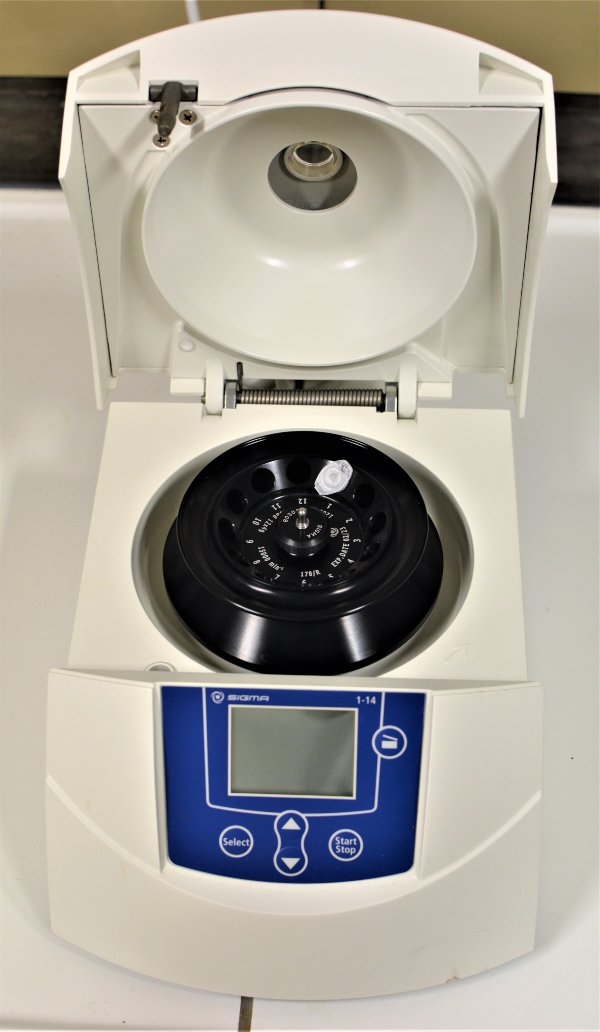
Die Bauart der Rotoren richtet sich nach Probenvolumen und Einsatzbereich. Mit Tischzentrifugen werden Probenmengen im µl- und ml-Bereich getrennt, größere Zentrifugen können bis zu mehreren hundert Millilitern an Probenvolumen aufnehmen.
Die relative Zentrifugalbeschleunigung g variiert dabei von einigen 103 g bis zu mehreren 106 g, wobei 1 g der Erdbeschleunigung entspricht. Für hohe Umdrehungszahlen werden Ultrazentrifugen eingesetzt, die im Vakuum betrieben werden, um den Luftwiderstand und damit entstehende Reibungswärme zu vermeiden.


Zentrifugen unterscheiden sich auch durch den Rotortyp
Häufig besitzen Zentrifugen einen Festwinkelrotor, bei dem die Zentrifugengefäße in einem festen Winkel von circa 30° zur Rotorachse zentrifugiert werden. Bei einem Vertikalrotor stehen die Probenröhrchen vertikal, d.h. senkrecht zur Rotorachse. Dieser Rotortyp hat den Vorteil sehr kurzer Sedimentationsstrecken und Zentrifugationszeiten, weshalb er vor allem für Bereiche mit hohem Probendurchsatz geeignet ist.
Eine Variante hiervon ist der sogenannte NVC-Rotor, wobei NVC für Near Vertical Centrifugation steht. Die Zentrifugengefäße stehen hier in einem kleinen Winkel zur Rotorachse, üblich sind Winkel zwischen 7,5° und 9°, was die Probenentnahme erleichtern soll.

Im Ausschwingrotor schwingen die Probengefäße beim Zentrifugieren horizontal in Richtung des Schwerefeldes. Dieser Rotortyp wird vor allem für die Trennung von großen Volumina gerne eingesetzt.
Verschiedene Zentrifugationsverfahren für unterschiedliche Fragestellungen
Mit der differentiellen, der isopyknischen und der Zonenzentrifugation gibt es drei verschiedene Techniken, die unterschiedliche physikalische Parameter für die Trennung ausnutzen.


Die differentielle Zentrifugation nutzt Unterschiede in der Sedimentationsgeschwindigkeit
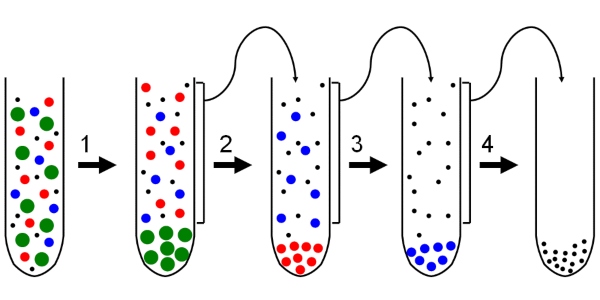
Mittels differentieller Zentrifugation werden die verschiedenen Zellbestandteile eines Zellextrakts durch ihre unterschiedlichen Sedimentationsgeschwindigkeiten getrennt. Sie ist immer der erste Schritt, wenn im Labor mit der Probenaufbereitung begonnen wird. Hierbei wird die Probe nacheinander bei verschiedenen g-Zahlen zentrifugiert und der Überstand jeweils im nächsten Zentrifugationsschritt eingesetzt. Ein typisches Schema zur Auftrennung eines Zellextrakts sieht folgendermaßen aus:
- Im ersten Zentrifugationsschritt werden bei 1000 g ganze Zellen und Zellkerne abzentrifugiert und finden sich als Niederschlag am Boden des Zentrifugenbechers oder –röhrchens als sogenanntes Pellet.
- Der Überstand wird im nächsten Schritt bei 2000 g zentrifugiert, wodurch Zellbestandteile, wie Mitochondrien, Peroxisomen und Lysosomen als Pellet abgetrennt werden.
- Bei 80.000 g werden Mikrosomen und kleine Vesikel vom Rest abgetrennt, während große Komplexe, beispielsweise Ribosomen, erst bei einer Beschleunigung von 150.000 g
Damit ist die differentielle Zentrifugation eine sehr einfache Technik, um verschiedene Zellfraktionen zu erhalten.
Isopyknische und Zonenzentrifugation nutzen Dichtegradienten
Die Zonenzentrifugation ist für die Auftrennung von Teilchen mit ähnlichen Sedimentationsgeschwindigkeiten, aber unterschiedlichen Größen, geeignet. Hier wird die Probe auf einen diskontinuierlichen Dichtegradienten, beispielsweise einen Saccharosegradienten, aufgegeben. Dieser besteht aus Schichten aufsteigender Konzentration, typischerweise zwischen 18 und 30 %, und damit zunehmender Dichten. Durch vorsichtiges Überschichten der verschieden konzentrierten Lösungen entsteht der Dichtegradient, wobei sich die Saccharoselösung mit der höchsten Dichte am Boden des Zentrifugenbechers oder –röhrchens befindet.
Die Probe wird anschließend für einen definierten Zeitraum bei niedrigen Umdrehungszahlen zentrifugiert. Die Teilchen wandern aufgrund der verschiedenen Dichten mit unterschiedlichen Sedimentationsgeschwindigkeiten und trennen sich dadurch in diskreten Banden auf. Am Ende können diese vorsichtig mit einer Pasteurpipette abgesaugt werden.
Wichtig ist, die Zentrifugation nach einer bestimmten Zeit abzubrechen, da anderenfalls alle Teilchen irgendwann bis zum Boden des Zentrifugengefäßes wandern würden.
Die isopyknische Zentrifugation, die auch als Sedimentations-Gleichgewichtszentrifugation bezeichnet wird, ist für Teilchen mit ähnlicher Größe, aber unterschiedlicher Dichte geeignet. Auch bei dieser Technik wird ein Dichtegradient genutzt, der aber nicht vorher geschichtet wird, sondern sich beim Zentrifugieren selbst als kontinuierlicher Gradient ausbildet. Die Zentrifugation erfolgt bei hohen g-Zahlen und ist zeitintensiv, da sich ein stabiler Gradient teilweise erst nach 24 bis 48 Stunden ausbildet. Bei dieser Methode wandern die Partikel im Gradienten bis genau zu jener Stelle, bei der die Dichte des Mediums ihrer eigenen entspricht. Da in dieser sogenannten isopyknischen Zone die Sedimentationsgeschwindigkeit gleich null ist, wandern die Teilchen nicht mehr weiter, sodass auf die Zentrifugationsdauer nicht so akribisch geachtet werden muss wie bei der Zonenzentrifugation.
Die in den einzelnen Schichten enthaltenen Teilchen sind bei einem kontinuierlichen Gradienten meist nicht deutlich erkennbar, weshalb diese nicht von oben mit einer Pipette abgesaugt werden, sondern ein Loch in den Zentrifugenboden gestochen und der Inhalt fraktioniert aufgefangen wird. Ein typisches Medium für einen kontinuierlichen Gradienten sind Cäsiumchlorid-Lösungen (CsCl), mit deren Hilfe beispielsweise Nukleinsäuren aufgetrennt werden können.
Die analytische Ultrazentrifugation hilft bei speziellen Fragestellungen
Eine nicht ganz alltägliche Zentrifuge im Labor ist die analytische Ultrazentrifuge. Dabei handelt es sich um eine Kombination aus Ultrazentrifuge und einem optischen Detektor, entweder ein Spektrophotometer oder Refraktometer. Statt Probenröhrchen werden hier UV-durchlässige Küvetten mit Fenstern aus Quarz oder Saphir eingesetzt. Zu Beginn und während der Zentrifugation wird die Absorption der Lösung wiederholt gemessen, woraus die Konzentrationen der sedimentierenden Teilchen bestimmt werden können. Aus den Messwerten können beispielsweise die exakten Sedimentationskoeffizienten von Molekülen ermittelt werden.
Ein anderer wichtiger Bereich umfasst die Untersuchung von Molekülkomplexen, da sich einzelne und zu Komplexen assoziierte Moleküle in ihren Sedimentationsgeschwindigkeiten unterscheiden.
So dient diese Technik beispielsweise zur Untersuchung von Protein-Protein- oder Protein-DNA-Wechselwirkungen.
Neben den verschiedenen anderen Techniken zur Probenvorbereitung und Separation gehört die Zentrifugation bis heute zu den wichtigsten und weit verbreiteten Techniken im biochemischen Labor.
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin